Определение
Креатинфосфокиназа (CPK), или просто креатинкиназа (CK), является ферментом, который помогает регулировать концентрацию аденозинтрифосфата (ATP) в клетка, Для этого креатинкиназа катализирует движение фосфатная группа от АТФ до креатина, образуя фосфокреатин. Эта молекула сохраняет фосфатную группу в стабильной форме, выступая в качестве резервуара энергии в клетках. Клетки с высокими требованиями к АТФ имеют более высокий уровень креатинкиназы.
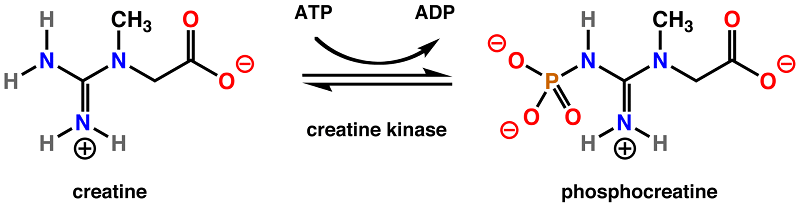
Фосфокреатин намного более стабилен, чем АТФ, и не может напрямую использоваться большинством ферментов. Вместо этого креатинкиназа должна обратить реакцию, чтобы переместить фосфатную группу обратно в молекулу АДФ, чтобы сформировать больше АТФ, энергетической валюты клетки.
В результате, мускул клетки, сердечные клетки и другие клетки с высоким спросом на энергию могут накапливать энергию, не нарушая равновесие АТФ. Это позволяет клетке продолжать производить АТФ и накапливать дополнительную энергию, когда это необходимо.
Уровень креатинкиназы в крови
Уровень креатинкиназы в пределах кровь измеряется в единицах активности фермента (U) на литр крови (L) или U / L. Типичный диапазон для здоровых людей составляет от 20 до 200 ед / л.
Клинически уровень креатинкиназы в крови является мерой повреждения ткань обогащен ферментами. Например. фермент повышен в случае мышц или сердце наносить ущерб. Это может быть результатом сердечного приступа, травмы мышц, интенсивных физических упражнений, некроза мышц, травм почек или нервно-мышечных нарушений. Таким образом, уровни креатинкиназы часто используются в качестве биомаркера для сердечных событий или повреждения мышц.
Уровень креатинкиназы в этих случаях может достигать 50000-20000 Ед / л или даже выше в течение исключительные случаи тяжелого разрушения мышц (рабдомиолиз).
Креатинкиназа Функция
Креатинкиназа встречается главным образом в тканях, которые требуют много АТФ. Мышечные клетки, нервные клетки и даже сперматозоиды являются примерами высокоактивных клеток, которые содержат большое количество фермента. Это потому, что эти клетки должны использовать большое количество АТФ для выполнения своих функций.
Из-за природы АТФ, он должен оставаться в пределах жестко регулируемые концентрации сохранить функцию различных биохимических путей. Следовательно, энергия АТФ должна удерживаться в другом месте, пока она не понадобится. Этот резервуар представляет собой фосфокреатин, который представляет собой просто молекулу креатина, присоединенную к фосфатной группе.
Энергия, удерживаемая в этой фосфатной группе, может быть эффективно и быстро преобразована креатинкиназой в АТФ или из него. Когда есть слишком много АТФ, фермент функционирует, чтобы снизить концентрацию путем преобразования АТФ в АДФ. Он хранит дополнительный фосфат в молекуле креатина, создавая фосфокреатин. Пул фосфокреатина в клетке намного больше, чем количество легкодоступного АТФ. По этой причине он считается «топливным баком» или системой хранения энергии.
Как митохондрии производить АТФ через дыхание (особенно через окислительного фосфорилирования ), энергия передается молекулам фосфокреатина, которые перемещаются в цитоплазма клетки. Цитоплазматическая креатинкиназа может затем высвобождать энергию, запасенную в фосфокреатине, путем регенерации АТФ, позволяя клетке использовать эту химическую энергию.
Следовательно, креатинкиназа поддерживает энергетический резервуар, эффективно экономя АТФ. Это формирует то, что известно как Фосфокреатиновый контур, и имеет важное значение для регулирования клеточной гомеостаз.
Структура креатинкиназы

Структура креатинкиназы обеспечивает его сродством к креатину и фосфокреатину, что позволяет ему катализировать их соответствующие превращения. Еще один сайт по ферменту посвящен взаимодействию с АТФ и АДФ. Когда обе молекулы присоединяются к ферменту, он либо берет фосфатную группу из АТФ и добавляет ее в креатин, либо берет фосфатную группу из фосфокреатина и переносит ее в АДФ. Конечным результатом является либо создание, либо использование ATP.
Существует несколько типов креатинкиназы, кодируемой разными генами. Хотя эти формы креатинкиназы отличаются по своей аминокислотной структуре, их функция остается схожей. Тем не менее, небольшие изменения в их структуре и функции позволяют креатинкиназе работать в различных условиях.
изоферментов
Креатинкиназа представляет собой димер (он состоит из двух субъединиц, которые объединяются для создания одного функционального фермента). Существуют две различные формы этих субъединиц, тип B и тип M. Тип B обозначает ‘головной мозг тип ‘, потому что эта субъединица чаще всего связана с мозгом. Тип М обозначает «тип мышц», потому что эта субъединица чаще всего ассоциируется с скелетная мышца.
Следовательно, существует три различных изофермента креатинкиназы, которые образуются в результате различных комбинаций этих субъединиц: фермент с двумя мышечными субъединицами (CK-MM), фермент с двумя мозговыми субъединицами (CK-BB) и фермент с одним каждого (СК-МБ). Эти ферменты находятся в цитоплазме клеток и показывают тканеспецифическую локализацию. CK-BB обнаруживается в основном в головном мозге, CK-MM – в основном в скелетных мышцах, а CK-MB – в сердечная мышца.
Есть также две формы фермента, обнаруженные только в митохондриях (CK-Mt). Вездесущий CK-Mt неаркометрический и обнаруживается в различных тканях, таких как мозг, гладкая мышца и сперма. Саркомерический Mt-CK экспрессируется только в сердечной и скелетной мышцах.
Различные формы креатинкиназы выполняют одну и ту же функцию, но в разных условиях. Эти различные формы необходимы для управления резервуаром энергии во многих различных типах клеток. В большинстве клеток этот резервуар фосфокреатина поддерживается в концентрации, значительно превышающей концентрацию АТФ. Это позволяет выполнять множество задач по сбору энергии.
Креатинкиназный тест
Различные формы креатинкиназы делают его полезным диагностическим инструментом. Как и другие ферменты, креатинкиназа попадает в кровоток, когда клетка становится поврежденной. Если многие клетки повреждены одновременно, обнаруживаемый уровень фермента (и других) обнаруживается в крови. Врачи могут определить, какая форма фермента находится в крови, что может дать им понять, какие органы повреждены.

Тест может определить, что это сочетание мышечной и мозговой креатинкиназы, которая присутствует в крови (CK-MB). Это свидетельствует о повреждении сердца. Кроме того, поскольку фермент быстро исчезает из крови, его можно использовать в качестве индикатора для определения того, когда в системе произошло повреждение. Это может помочь найти причину серьезных проблем с сердцем.
викторина
Список используемой литературы
Показать спрятать