Определение пептидной связи
Пептидная связь представляет собой Ковалентная связь образуется между двумя аминокислоты, Живые организмы используют пептидные связи для образования длинных цепочек аминокислот, известных как белки. Белки используются во многих ролях, включая структурную поддержку, катализирование важных реакций и распознавание молекул в окружающей среде. Следовательно, пептидная связь является основой большинства биологических реакций. Формирование пептидных связей является требованием для всей жизни, и процесс очень похож во всех формах жизни.
Формирование пептидной связи
На молекулярном уровне пептидная связь образуется в результате реакции дегидратации. Как видно на рисунке ниже, две аминокислоты способны связываться вместе, когда два молекулы водорода и кислорода удаляются из молекул. Одна аминокислота представляет собой карбоксильная группа к реакции, и теряет гидроксильная группа в реакции (С двойно связан с О). Аминогруппа другой аминокислоты теряет водород. Затем азот замещает вместо гидроксильной группы, образуя пептидную связь. Вот почему пептидные связи также известны как замещенные амидные связи. Две аминокислоты теперь известны как остатки, поскольку они потеряли несколько атомов, и теперь они ковалентно связаны друг с другом.
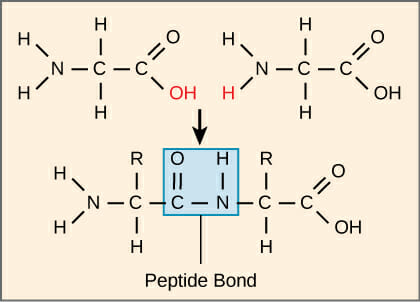
Связи углерод-азот, образованные в пептидной связи, отличаются от углерод-азотных связей в других частях молекула, Кислород на карбоксильной стороне связи имеет слегка отрицательный заряд. Азот сохраняет слегка положительный заряд. Это взаимодействие приводит к тому, что углерод и азот разделяют больше избирателей, чем обычно, и создается электрический диполь. Дополнительные электроны заставляют связь действовать как двойная связь, которая является жесткой и не может вращаться. Эта единица из 6 молекул известна как пептидная группа и часто изображается в виде шара или плоской плоскости. Углероды в центрах каждой аминокислоты имеют 4 одинаковые связи и могут свободно вращаться. Таким образом, когда многие аминокислоты связаны вместе, они образуют цепочки жестких плоскостей атомов вокруг пептидной связи, связанных гибкими углеродными связями. Это позволяет пептидной цепи вращаться и изгибаться, что приводит к продвинутым образованиям, которые могут катализировать реакции.
В то время как ученые выяснили, как соединить цепочку из нескольких аминокислот, типичный белок имеет тысячи остатков, соединенных последовательно. Кроме того, реакция благоприятствует отдельным аминокислотам и требует совсем немного энергии активации. Поэтому создавать белки без ферментов нелегко. Чтобы сделать это эффективно, клетки разработали эффективный механизм для создания новых белков. В геноме каждого организм существуют кодоны, которые описывают разные аминокислоты. Геном несет точную последовательность этих аминокислот, которые вместе дадут функциональный белок. Во-первых, информация должна быть скопирована на мессенджер РНК (мРНК ) молекула. Далее перенос РНК (тРНК ) связывается с определенными аминокислотами. Эти тРНК соответствуют разным кодонам мРНК, которые, в свою очередь, соответствуют разным кодонам ДНК. Фактическая пептидная связь образуется в особой макроструктуре белка, известной как рибосома, изображенный ниже.
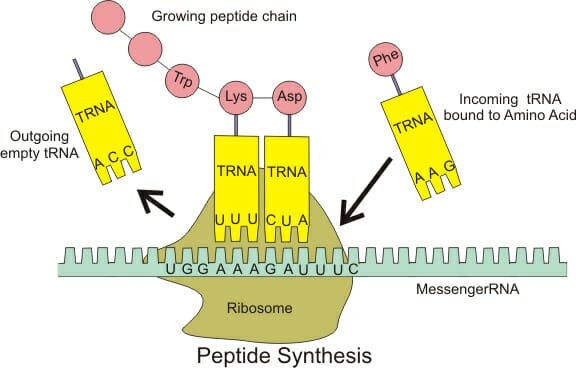
Рибосома представляет собой очень большую и сложную клеточную структуру, состоящую из белков, РНК и различных других компонентов, которые помогают катализировать образование пептидной связи. Это известно как стадия удлинения синтеза белка. Рибосома помогает сопоставить тРНК с соответствующей мРНК. В свою очередь, РНК слегка меняет форму, что катализирует реакцию между двумя аминокислотами и выталкивает молекулу воды. Образовавшаяся цепь выходит из рибосомы. Рибосома, будучи большим белком, сама меняет форму после того, как реакция прошла, и движется дальше вниз по цепи мРНК, начиная процесс заново. В конце концов встречается кодон, который сигнализирует об окончании белка, давая рибосоме знать, что весь белок был создан. В этот момент мРНК и новый белок будут удалены, и будет взята новая мРНК, создавая совершенно другой белок.
Вся жизнь основана на связях между примерно 20 различными аминокислотами, которые все организмы используют и модифицируют для своих собственных целей. Число различных комбинаций не ограничено, в то время как пептидные группы в белках образуют пептидные остовы во всех белках. Различные группы, присоединенные к каждой аминокислоте, заставляют молекулу складываться и изгибаться в сложные структуры из-за слабых взаимодействий между молекулами разных групп. Таким образом, во многих миллионах белков, созданных различными вид существует несколько очень похожих структур, которые соответствуют сходным последовательностям аминокислот. Поскольку аминокислоты соединены последовательно в сходном направлении, ученые обычно рисуют и идентифицируют белки, начиная со стороны аминокислоты или азота и проходя через карбоксильный конец в качестве конечной точки.
викторина
1. Когда организм потребляет другие организмы, он должен разбирать пептидные связи между аминокислотами, чтобы иметь возможность использовать аминокислоты в своих собственных белках. Что из следующего требуется для переваривания белков?A. желудок кислотаB. водаC. Зубы
Ответ на вопрос № 1
В верно. В то время как кислотная природа желудочной кислоты помогает денатурация белки и разворачивать их, пептидные связи разрываются в противоположном направлении, в котором они были сформированы. Поскольку молекула воды была потеряна при создании связи, молекула воды должна быть использована для разделения двух аминокислотных остатков. С добавлением воды аминокислоты станут свободными и могут присоединяться к тРНК, что добавит их к новому белку. В то время как зубы помогают многим организмам в начальном разрушении больших масс клеток, зубы почти ничего не делают с пептидными связями белков. Они должны быть химически переварены.
2. Ученому необходимо производить большое количество определенного белка для медицинских целей. Какой из этих методов будет наиболее успешным в крупномасштабном производстве белка?A. Изготовление отдельных белков в пробирках.B. Генная инженерия бактерии создать белок.C. Сбор и очистка белка от природы.
Ответ на вопрос № 2
В верно. Процесс создания отдельных белков в пробирках практически невозможен. Количество аминокислот, связанных в определенной последовательности, сделает массовое производство строгим процессом. Хотя сбор белка в природе может быть полезным, маловероятно, что какие-либо организмы производят его в достаточном количестве, чтобы быть полезным. Кроме того, вам придется сортировать конкретный белок из тысяч или миллионов других белков. Самый быстрый и эффективный способ массового производства белков – это сделать так, чтобы генно-инженерный организм сделал это за вас. Размещая много копий ген который производит белок, желаемый в простых бактериях, бактерии могут производить большие количества белка. Пептидные связи белка будут образованы теми же эффективными клеточными механизмами, которые продуцируют все природные белки, но они будут гораздо более концентрированными, чем в природе.
3. Пептидные связи между аминокислотами валина и тирозина такие же, как пептидные связи между аминокислотами серина и лизина. Тем не менее, даже эти маленькие дипептиды ведут себя очень по-разному в отношении того, как вся молекула изгибается и складывается. Если пептидные связи одинаковы, что вызывает эту разницу?A. Каждая аминокислота имеет специфическую боковую цепь, которая взаимодействует с окружающей средой.B. Углерод в каждой аминокислоте отличается, вызывая различную форму.C. Аминогруппы каждой аминокислоты вызывают изменения в форме.
Ответ на вопрос № 3
верно. Боковые цепи аминокислот, обычно обозначаемые буквой «R» на простых иллюстрациях аминокислот, на самом деле являются большими и сложными молекулами, которые торчат из пептидного остова и взаимодействуют друг с другом и с окружающей средой. Слабые взаимодействия между этими боковыми цепями притягивают и скручивают общую молекулу в различные формы. Фактически, углерод и аминогруппы каждой аминокислоты одинаковы и образуют жесткие части молекулы, которые не могут двигаться. Альфа-углерод, или центральный.