Определение осмотического давления
Осмотическое давление можно рассматривать как давление, необходимое для предотвращения распространения воды через барьер осмос, Другими словами, это относится к тому, как сильно вода «проталкивается», чтобы пройти через барьер, чтобы распространиться на другую сторону.
Осмотическое давление определяется растворенное вещество концентрация – вода будет «стараться» диффундировать в область с высокой концентрацией растворенного вещества, такого как соль, чем в область с низкой концентрацией.
В действительности, конечно, осмотическое давление – это не «желание» воды двигаться, а скорее продолжение естественного закона, согласно которому вся материя со временем будет случайным образом распределяться. Когда концентрации веществ различны в двух областях, и области имеют контакт друг с другом, случайное движение частиц заставит вещества диффундировать до решение равномерно по всей области.
Осмос является особенным диффузия воды через полупроницаемую мембрану. Таким образом, в случае осмоса растворенные вещества не могут двигаться, потому что они не могут проходить через мембрану. Однако вода может двигаться, и это происходит – проходя через мембрану в область с более высокой концентрацией растворенного вещества.
Это может привести к изменению общего объема воды на каждой стороне мембраны: на стороне мембраны с большим количеством растворенных веществ может оказаться гораздо больше воды. Это может привести к проблемам для клеток, таким как взрыв (если слишком много воды попадает в клетка ) или становится обезвоженным (если слишком много воды уходит).
Это очень важный фактор в биологии, потому что внутриклеточная среда отличается от внеклеточной среды. Если изменяется внеклеточная среда, это может привести к попаданию воды в наши клетки.
Некоторые организмы, такие как растения, которые используют осмотическое давление для перемещения воды, воспользовались этим принципом. Но это также может угрожать здоровью клеток и организмов, когда во внеклеточной среде слишком много или слишком мало воды по сравнению с внутренней частью клетки.
Уравнение осмотического давления
Осмотическое давление может быть рассчитано с использованием следующего уравнения:
π = MRT
В этом уравнении:
π
Важно отметить, что π не равно 3.14… в этом уравнении!
Вместо этого здесь «π» – символ, используемый для обозначения осмотического давления. Вы можете думать об этом уравнении как о решении для «π» так же, как о решении для X.
В символе «π» нет ничего особенного, кроме того, что на международном уровне химики согласились обозначать осмотическое давление.
M
М – молярная концентрация растворенного вещества. Молярная концентрация относится к фактическому количеству атомов, ионов или молекул растворенного вещества.
Это важно, потому что именно количество частиц определяет, как частицы взаимодействуют при осмосе, а не объем или вес.
Сколько моль – единица измерения частиц – весит, или сколько он занимает, будет варьироваться в зависимости от молекулярного веса и плотности растворенного вещества.
р
R – идеальная газовая постоянная.
Хотя постоянная идеального газа была создана для обозначения газов и их диффузии и поведения, она также применима к жидкостям.
В химии и жидкости, и газы считаются «жидкостями» – частицами, которые могут свободно диффундировать, в отличие от твердых тел, частицы которых удерживаются на месте прочными связями.
T
Т – температура в градусах Кельвина.
Один градус Кельвина равен одному градусу Цельсия, но между двумя измерительными системами есть важное различие.
Температура является мерой энергии в молекулах. При более высоких температурах молекулы движутся быстрее; при более низких температурах они движутся медленнее. Вот почему температура так важна для этого уравнения: чем быстрее частицы подвергаются случайному молекулярному движению, тем быстрее они будут диффундировать.
В градусах Цельсия «ноль градусов» считается точкой замерзания воды. Это произвольное число, выбранное учеными, потому что замерзание воды является обычным явлением. Температура по Цельсию может быть положительной (выше нуля) или отрицательной (ниже нуля).
Но в Кельвине «ноль градусов» – это температура, при которой не происходит молекулярного движения. На самом деле это абсолютный ноль – невозможно стать холоднее, чем «отсутствие молекулярного движения».
В результате Кельвин используется во многих химических уравнениях, потому что это абсолютная мера тепла. Если вещество находится при 300 градусах Кельвина, вы точно знаете, сколько тепла находится в веществе: всего 300 Кельвинов.
Для ученых это гораздо лучше, чем вычислять, основываясь на градусах Цельсия, и, например, нужно выяснить, сколько тепла в воде при температуре -30 градусов Цельсия.
Забавный факт: абсолютный ноль – ноль Кельвин – это -273,15 градусов по Цельсию. Другой способ сказать, что ноль градусов по Цельсию – точка замерзания воды – происходит в 273,15 Кельвинов.
Примеры осмотического давления
Увядшие растения
Многие растения фактически используют осмотическое давление для поддержания формы своих стеблей и листьев.
Если вы сохранили растения в горшках, вы, вероятно, знаете, что ваши растения могут очень быстро увядать, если их не поливать. Но в течение нескольких минут после полива они могут взбодриться!
Это происходит потому, что стебли и листья многих растений по существу «надуваются» осмотическим давлением – соли в клетках заставляют воду всасываться через осмос, делая клетку упругой и упругой.
Если воды недостаточно, растение будет увядать, потому что его клетки становятся «спущенными». В научном плане они «гипертонический »- что означает« концентрация растворенного вещества слишком высока ».
Растения также могут демонстрировать силу осмотического давления по мере роста.
Возможно, вы видели растения, растущие сквозь асфальт, или корни деревьев, растущие сквозь кирпичи или бетон.
Это также стало возможным благодаря осмотическому давлению: по мере роста растений их клетки поглощают больше воды. Медленное, но неумолимое давление воды, движущейся через растительная клетка Мембраны действительно могут протолкнуть асфальт!
Эффекты обезвоживания – и чрезмерного увлажнения
Мы все знаем об опасности обезвоживания, когда недостаток воды может вызвать опасные последствия для нашего организма. Чего мы не могли бы понять, так это того, что эти эффекты напрямую связаны с осмотическим давлением.
Когда наши тела не имеют достаточного количества воды, вода может фактически выйти из наших клеток в наши кровь, Это может привести к тому, что концентрации солей и других растворенных веществ в наших клетках станут слишком высокими, что повлияет на клеточную функцию.
Когда мы пьем воду, вода попадает в организм через наши кровяные потоки и способна диффундировать обратно в наши клетки через осмос, восстанавливая их правильную функцию.
Возможно и обратное: на самом деле можно умереть, выпив слишком много воды.
Трудно случайно «передозировать» воду, но в экстремальных случаях, таких как соревнования по питью воды, можно выпить столько воды, что слишком много ее диффундирует в ваши клетки. В крайних случаях это может вызвать отек головной мозг.
Быстрая регидратация после тяжелой дегидратации может быть опасной по той же причине. Рекомендуется проводить регидратацию медленно, потому что внезапное заполнение обезвоженных клеток большим количеством воды может привести к их взрыву!
На рисунке ниже показано, как обезвоживание – или чрезмерное увлажнение – может влиять на наши клетки крови, вызывая их усыхание или взрыв: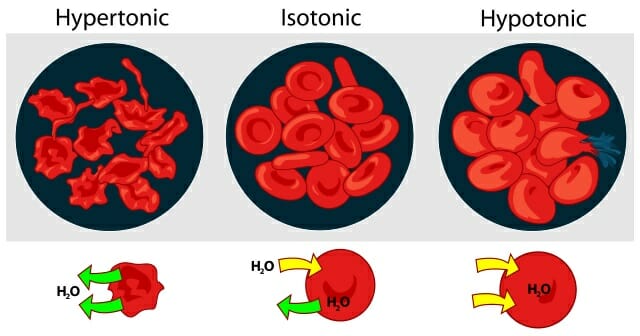
- диффузия – Процесс, посредством которого жидкости и растворенные вещества равномерно распределяются при случайном молекулярном движении.
- температура – мера средней кинетической энергии частиц в веществе. «У более теплых» веществ больше движения частиц, а у «более холодных» – меньше.
- вода – «универсальный растворитель На которой основана жизнь на Земле. Уникальные свойства воды делают ее идеальным носителем для молекул жизни, таких как сахара, аминокислоты и нуклеиновые кислоты.
викторина
1. Что из следующего НЕ верно для осмоса?A. Это относится конкретно к движению воды через полупроницаемую мембрану.B. Это может произойти только там, где есть мембрана, которая проницаема для воды.C. Это может относиться к любому диффузионному процессу с участием воды.D. Ни один из вышеперечисленных.
Ответ на вопрос № 1
С верно. Осмос относится только к диффузии воды через полупроницаемую мембрану. Другие типы диффузии, такие как диффузия без мембраны, не являются осмосом.
2. Что из следующего НЕ является переменной в уравнении для осмотического давления?A. π – значение 3.14…B. М – молярная концентрация растворенного вещества.C. Р – Закон идеального газа.D. Т – температура раствора в градусах Кельвина.
Ответ на вопрос № 2
верно. Это хитрый! Хотя символ «π» появляется в уравнении для осмотического давления, здесь он НЕ означает значение «3.14…», используемое в геометрии.
Вместо этого он просто используется как символ, представляющий решение вашего уравнения – осмотическое давление вашего решения. Здесь значение «π» является тем, каким оказывается осмотическое давление.