Определение Гема
Гем органический, кольцеобразный молекула, Благодаря своей особой структуре гем способен удерживать или «содержать» молекулу железа. Гем состоит из 4 пирролов, которые представляют собой небольшие молекулы в форме пятиугольника, состоящие из 4 атомов углерода и 1 азота. Четыре пиррола вместе образуют тетрапиррол. Если тетрапиррол имеет замены на боковых цепях, которые позволяют ему удерживать ион металла, он называется порфирина, Таким образом, гем представляет собой железосодержащий порфирин.
Молекула железа в геме удерживается на месте сбалансированными силами притяжения четырех молекул азота. Все молекулы азота направлены внутрь большего кольца, которое они создают. Двойные и одинарные связи, которые соединяют пирролы, расположены равномерно, так что электроны остаются сбалансированными, а вся молекула остается стабильной. Это делает его ароматической молекулой. Молекула гема может быть замечена ниже.
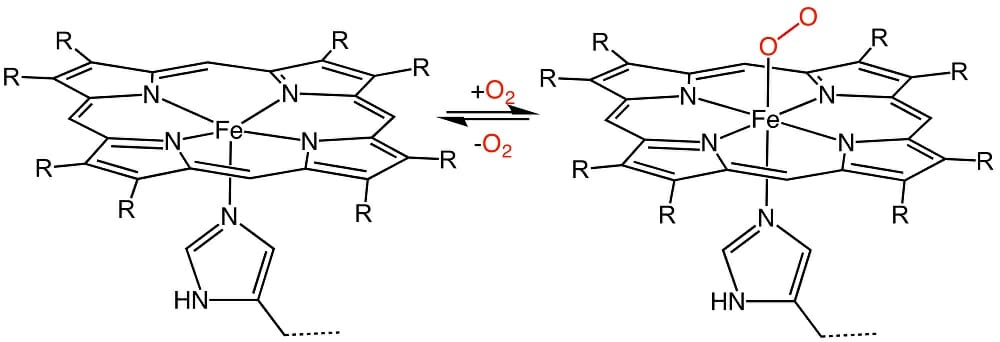
Гемы используются по двум известным причинам: для переноса кислорода и для транспортировки или хранения электронов. На изображении выше вы можете видеть, как газообразный кислород может обратимо связываться с гемовым комплексом. Организмы используют молекулу гема в комплексе с белками особой формы для транспорта кислорода и перемещения электронов. Эти специальные белки, такие как гемоглобин и миоглобин, созданы для того, чтобы помочь комплексу гема удерживать или выделять кислород в подходящее время.
Гем назван в честь греческого производного от «кровь ”, Где это было впервые идентифицировано. Красный цвет крови образуется при взаимодействии гема и иона железа с поглощением других цветов и отражением только красного. Несколько иной эффект виден в хлорофилл, Хлорофилл представляет собой порфириновый комплекс, используемый в фотосинтез, Вместо железа в хлорофилле содержится ион магния, а хлорофилл имеет боковые цепи, отличные от гемовой группы. Это производит зеленый цвет растений, а не красные и пурпурные цвета крови.
Структура гема
Как и все порфирины, гем имеет основную структуру большого кольца из четырех пирролов. Эта основная молекула, редко встречающаяся в природе как промежуточное звено, называется порфином. Существует много различных форм гема, которые соответствуют множеству функций, которые он должен выполнять в организм, Конкретные белки используют различные боковые цепи для прикрепления, и они изменяют свойства гема. Тем не менее, базовая структура всегда одинакова. Это тетрапиррол, показанный ниже.

Числа на молекулах указывают точки, в которых молекула может получать замены и модифицироваться для конкретного использования. Различия в боковых цепях, прикрепленных к атомам углерода 3, 8 и 18, составляют разницу между некоторыми из наиболее распространенных групп гемов. Например, как гемоглобин, так и миоглобин несут гем B. В гем B переносится кислород, а белки, которые он связывает, помогают ему высвобождать кислород в нужное время. Гем А, с другой стороны, работает в цепь переноса электронов как часть цитохрома с. Это означает, что он участвует в транспортировке белков и катализировании реакций. Единственная разница между двумя молекулами заключается в боковых цепях, прикрепленных к углеродам 3 и 18. Боковая цепь на углероде 8 остается неизменной.
Функция Гема
Гем имеет две понятные функции. Он может связывать газы, такие как кислород, и транспортировать их по всему организму. Затем специальные белки заставляют гем выделять кислород в соответствующее время. Хорошим примером белка этого типа является гемоглобин. Гемоглобин обнаружен во всех клетках крови, прикрепленных к клеточная мембрана, подвергая гемовую группу воздействию плазмы крови. Таким образом, когда клетки крови проходят через легкие, они связывают столько кислорода, сколько может выдержать железо в геме.
Затем клетки крови перемещаются в различные части тела, например в мышцы. Эти клетки активно используют кислород и выделяют углекислый газ в качестве побочного продукта. Углекислый газ образует кислоту в плазме крови, понижая рН крови. Как и все белки, гемоглобин реагирует на изменения pH путем изменения формы. Это изменение в форме вытесняет кислород из гемового комплекса, выделяя кислород в плазму крови. Кислород диффундирует в мускул клетки, где он связан с миоглобином и транспортируется к митохондрии использоваться. Миоглобин также имеет гемовую группу, но он действует по-другому, так что кислород остается связанным до достижения митохондрий.
Вторая функция гемов, удерживающая электроны и облегчающая реакции в цепи переноса электронов, встречается у всех организмов. В течение окислительного фосфорилирования в митохондриальной мембране электроны должны проходить серию реакций, которые медленно извлекают их энергию, прежде чем поместить их в воду и углекислый газ. Полученная энергия сохраняется в связях молекулы АТФ, которую большинство организмов используют в качестве основного источника энергии. Группы гемов в этих цитохромах отличаются от групп гемоглобина, поскольку они имеют разные функции и связываются с разными белками.
викторина
1. Как упоминалось в статье, гем встречается практически во всех живых организмах. Что это говорит о жизни на Земле?A. Всю жизнь развивал гем у общего предкаB. Гем является важным основным источником пищиC. Жизнь на Земле проста
Ответ на вопрос № 1
верно. У всех организмов есть гены, которые создают, распределяют и специализируют гем для своих целей. Однако это совсем не просто. Большое разнообразие форм, которые может принимать гем, до последних десятилетий ставило ученых в тупик относительно их предназначения и функций. С достижениями в биохимия и в физике становится все более очевидным, что гем приобретает свою важность благодаря своей способности удерживать ион металла.
2. Что произойдет, если вы замените весь миоглобин в организме гемоглобином?A. Ничего, организм все равно будет функционировать нормальноB. Организм не получит достаточно кислорода в митохондриях и умретC. Организм выживет, но будет слабым
Ответ на вопрос № 2
В верно. Миоглобин важен, потому что он не выделяет кислород в присутствии углекислого газа. Это гарантирует, что кислород связан полностью с митохондриями. Миоглобин также специально разработан для работы с клеточным оборудованием. Даже если углекислый газ не создал кислотных условий, гемоглобин не мог быть транспортирован вокруг внутренней части клетка, Комбинация обоих белков, в которых гем используется по-разному, позволяет транспортировать кислород через различные химические условия, присутствующие в организме.
3. Свободный гем может повредить ткани. Ион железа в геме очень реактивен и может создавать свободные радикалы. Эти ионы разрушают системы и останавливают клеточные процессы. Что из перечисленного может вызвать чрезмерный рыхлый гем?A. Повреждение мышцB. Мутированные ферменты, ответственные за переработку гемаC. Пить слишком много кофе
Ответ на вопрос № 3
В верно. Это состояние известно как порфирия, так как гем представляет собой тип порфирина. Это генетическое состояние, при котором гены гемовых ферментов мутируют. Если гем не может быть обработан должным образом, он накапливается без включения в белки. Гем в мышцах уже в белке. Когда ваши мышцы повреждены, миоглобин высвобождается, но гем остается в ловушке внутри.
Ссылки
- Lodish, H., Berk, A., Kaiser, C.A., Krieger, M., Scott, M.P., Bretscher, A.,. , , Мацудайра, П. (2008). Молекулярно-клеточная биология (6-е изд.). Нью-Йорк: W.H. Фримен и Компания.
- Нельсон Д.Л. и Кокс М.М. (2008). Основы биохимии. Нью-Йорк: W.H. Фримен и Компания.
- Pough, F. H., Janis, C.M. & Heiser, J. B. (2009). Жизнь позвоночных. Бостон: Пирсон Бенджамин Каммингс.