Определение константы равновесия
Константа равновесия, Keq, представляет собой переменную, которая описывает тенденцию химической реакции к завершению, то есть все реагенты превращаются в продукты. Равновесие реакции – это точка, в которой превращение реагентов в продукты равно конверсии продуктов обратно в реагенты.
Обзор константы равновесия
Большая константа равновесия означает, что реакция идет в прямом направлении, от реагентов до продуктов, пока почти все реагенты не будут превращены в продукты. Небольшая константа равновесия или когда Keq меньше единицы, означает, что химическая реакция благоприятствует реагентам, и реакция будет идти в противоположном направлении. Константа равновесия 1 указывает, что реагенты и продукты будут равны, когда реакция достигнет равновесия.
Ученые используют константу равновесия уравнения, чтобы лучше понять, как быстро будет достигнуто равновесие и будет ли равновесие благоприятствовать реагентам или продуктам. Константа может быть рассчитана с использованием отношения продуктов к реагентам, когда уравнение достигнет равновесия. Константа равновесия часто представлена переменной Keq, которая определяется выражением константы равновесия, показанным ниже.
Выражение константы равновесия для реакции
Выражение константы равновесия описывает концентрацию продуктов, деленную на концентрацию реагентов, когда реакция достигает равновесия. Это выражение можно увидеть ниже.
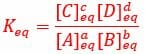
В реакции: аа + бб <=> cC + dD
Каждый термин описывает концентрацию реагента или продукта в реакции, в которой химические вещества A и B объединяются, образуя продукты C и D. Строчные буквы обозначают количество молей каждого химического вещества. Скобки вокруг буквы, [A]указать концентрацию каждого химического вещества, а нижний индекс означает, что константа равновесия определяется концентрацией каждого химического вещества. молекула в равновесии.
Дж. Уиллард Гиббс Известный ученый, изучавший энергию, присутствующую в реакциях, показал, что константа равновесия напрямую связана с величиной изменения свободной энергии, которое происходит во время реакции и обозначается как ∆G. Гиббс показал, что каждая реакция имеет стандартное изменение свободной энергии, или ∆G °. В то время как полное изменение свободной энергии каждой реакции также определяется начальными концентрациями химических веществ, стандартная свободная энергия рассчитывается с помощью приведенного ниже уравнения с использованием константы равновесия уравнения.
∆G ° = -RTln (Кек)
Это уравнение показывает, что стандартное изменение свободной энергии это просто другой способ описания движущих сил реакции и того, как они будут развиваться. В то время как константа равновесия говорит нам, будет ли у нас больше реагента или продуктов в конце реакции, это не намекает на то, как быстро будет происходить эта реакция. Это известно как константа скорости и обозначается строчной буквой k. Константа скорости связана с множеством других уравнений, связанных со скоростью, с которой происходят реакции. Константа равновесия важна для ряда биологических реакций, как видно из приведенных ниже примеров.
Примеры константы равновесия
Ионизация воды
Вода – основа всей жизни на Земле. Одна из главных причин, почему вода такая хорошая растворитель является его способность образовывать водородные связи как с собой, так и с не водяными молекулами. Эта способность не только позволяет воде растворять и рассеивать растворенные вещества, но также позволяет воде переносить электрический ток. Когда вода, H2O, образует водородные связи, водород отделяется от кислорода, и молекула диссоциирует на ион водорода (H +) и гидроксид-ион (OH–).
Отдельные протоны водорода редко существуют свободно в решение и сразу же образует связь с молекулой воды, с которой он был связан водородом. Это образует ион гидрония, или H3O +. Следовательно, константа равновесия для этой реакции представляет собой концентрацию ионов водорода и гидроксид-ионов, деленную на концентрацию нормальных молекул воды, как показано ниже.

Константа равновесия этой реакции может быть измерена по электропроводности воды, которая определяется концентрацией (H3O +). Ионы гидроксония передают электрический сигнал в виде переноса электронов, который может быть измерен чувствительным электрическим оборудованием. Таким образом, константа равновесия воды была измерена чувствительным электрическим оборудованием, чтобы быть 1,8 х 10-16, что означает, что вода имеет гораздо большую вероятность быть реагентом H2O, в отличие от превращения в ион гидрония Процесс можно увидеть на изображении ниже.

Можно также сказать, что эти реакции имеют положительное изменение в свободной энергии, то есть они выделяют энергию для реакций вокруг них. Другие важные реакции являются эндергоническими, то есть они требуют энергии, чтобы иметь место. Эти реакции имеют низкую константу равновесия, описывающую их тенденцию оставаться в качестве реагентов. Клетки связывают эти реакции, чтобы позволить эндергоническим реакциям иметь место. Это можно наблюдать во многих типичных клеточных реакциях, в которых используется высокая константа равновесия АТФ, превращающихся в АДФ, для стимулирования эндергонических реакций, таких как образование белков или жирные кислоты.